发布时间:2023-06-09
发布时间:2023-06-09
 阅读量:71
阅读量:71
随着科学技术的不断发展,当下分子生物学已成为生物学门类的重点领域。要进行分子生物学研究,各类生物大分子的提取、分离、浓度与纯度检测是常用的操作。本文以DNA为例简单介绍核酸的浓度&纯度检测及提纯方法。
DNA浓度&纯度的检测
目前常用紫外分光光度法检测核酸的浓度及纯度。
检测原理:
紫外分光光度法基于DNA链上碱基的苯环结构在紫光区具有较强吸收,DNA/RNA在260nm处有最大的吸收峰,蛋白质在280nm处有最大的吸收峰,盐和小分子则集中在230nm处。因此,可以用260nm波长进行分光测定核酸浓度,OD值为1相当于大约50ug/ml双链DNA,单链DNA浓度约为33ug/ml,RNA约为40ug/ml,寡核苷酸约为35ug/ml。如用H,O稀释DNA/RNA样品n倍并以H,O为空白对照,根据此时读出的OD260值即可计算出样品稀释前的浓度:
DNA (mg/ml ) =50×OD260 读数×稀释倍数/1000RNA (mg/ml) =40×OD260读数×稀释倍数/1000。

DNA纯度比值
DNA 纯度比值是表示DNA样本中 DNA 的相对浓度的指标,它是通过测量样本中不同物质的含量来计算的。A280nm是蛋白和酚类物质最高吸收峰的吸收波长,纯DNA的A260/A280比值为1.8,纯RNA为2.0。假如比值低,表示受到蛋白(芳香族)或分类物质的污染,需要纯化样品。比值=1.5相当于50%蛋白质/DNA溶液。A230nm是碳水化合物最高吸收峰的吸收波长,纯DNA和RNA的A260/A230比值为2.5。若比值小于2.0标明样品被碳水化合物(糖类)、盐类或有机溶剂污染,需要纯化样品。
实际上单纯从A260 / A230的数值上来判断糖类/盐分是否残留过高并不准确:即使残留相同浓度的盐分在核酸溶液中,某些盐分在230nm处有强吸收峰的,也会严重降低A260/A230的比值。但这并不等于核酸就不能使用了,不过一般仍认为较纯净的核酸A260/A230的比值应大于2.0。
A320nm或A340nm为检测溶液样品的浊度,该值应该接近0.0。假如不足,表明溶液中有悬浮物,需要纯化样品。
不同的实验需要的DNA纯度可能不同,因此需要根据实验的具体需求来确定DNA纯度的要求。在生物实验中,DNA纯度的需求往往比较高,因为高纯度的DNA能够确保实验结果的准确性和可靠性。
DNA纯度比值可能受到以下因素的影响:
1. 样本收集和存储方法:样本在收集和存储过程中可能会受到污染,影响DNA纯度。
2.DNA 提取方法:不同的DNA提取方法可能导致DNA纯度的不同。
3.生物样本的特性:不同的生物样本中的DNA含量和组成也可能导致DNA纯度的不同。
4.纯化步骤:在纯化DNA时,不同的纯化方法和操作步骤可能对DNA纯度产生影响。
5.测量方法:不同的测量方法可能产生不同的DNA纯度比值。
因此,为了确保DNA纯度的准确性,需要在每个步骤中注意控制可能影响DNA纯度的因素,并使用适当的方法和技术进行测量。
DNA提取方法
(一)经典DNA提取方法——酚氯提取法:
苯酚/氯仿提取DNA是利用酚是蛋白质的变性剂,反复抽提,使蛋白质变性,SDS(十二烷基磺酸钠)将细胞膜裂解,在蛋白酶K、EDTA的存在下消化蛋白质或多肽或小肽分子,核蛋白变性降解,使DNA从核蛋白中游离出来。DNA易溶于水,不溶于有机溶剂。蛋白质分子表面带有亲水基团,也容易进行水合作用,并在表面形成一层水化层,使蛋白质分子能顺利地进入到水溶液中形成稳定的胶体溶液。当有机溶液存在时,蛋白质的这种胶体稳定性遭到破坏,变性沉淀。离心后有机溶剂在试管底层(有机相),DNA存在于上层水相中,蛋白质则沉淀于两相之间。酚-氯仿抽提的作用是除去未消化的蛋白质。氯仿的作用是有助于水相与有机相分离和除去DNA溶液中的酚。抽提后的DNA溶液用2倍体积的无水乙醇在1/103mol/LNaCl存在下沉淀DNA,回收DNA用70%乙醇洗去DNA沉淀中的盐,真空干燥,用TE缓冲液溶解DNA备用。
(二)真核细胞DNA的制备:
一般真核细胞基因组DNA有107-109bp,可以从新鲜组织、培养细胞或低温保存的组织细胞中提取,常是采用在EDTA以及SDS等试剂存在下用蛋白酶K消化细胞,随后用酚抽提而实现的。这一方法获得的DNA不仅经酶切后可用于Southern分析,还可用于PCR的模板、文库构建等实验。
根据材料来源不同,采取不同的材料处理方法,而后的DNA提取方法大体类似,但都应考虑以下两个原则:
1、防止和抑制DNase对DNA的降解。
2、尽量减少对溶液中DNA的机械剪切破坏。
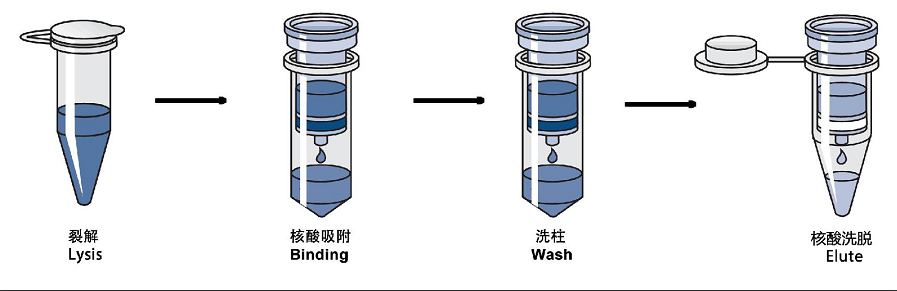
(三)DNA提取试剂盒制备DNA模板
DNA提取试剂盒是适用于PCR研究的快速提取DNA的方法,与经典酚氯提取法相比,高效、快速的提取纯度较高的DNA,操作过程简单,无毒无味,所需样品材料的量较少;但价格较为昂贵,且产出DNA的量少。现今全血DNA提取试剂盒、细胞及组织DNA提取试剂盒等均已商品化,可在生物公司购买,其具体实验步骤参照试剂盒中提供的说明书操作。
DNA提取的注意事项
1. 裂解液要预热,以抑制DNase,加速蛋白变性,促进DNA溶解。
2.酚一定要碱平衡,使用平衡饱和酚。苯酚具有高度腐蚀性,飞溅到皮肤、粘膜和眼睛会造成损伤,因此应注意防护。氯仿易燃、易爆、易挥发,具有神经毒作用,操作时应注意防护。
3.各操作步骤要轻柔,尽量减少DNA的人为降解。
4.取各上清时,不应贪多,以防非核酸类成分干扰。
5.异丙醇,乙醇.NaAc,KAc等要预冷,以减少DNA的降解,促进DNA与蛋白等的分相及DNA沉淀。
6.提取DNA过程中所用到的试剂和器材要通过高压烤干等办法进行无核酸酶化处理。
7.所有试剂均用高压灭菌双蒸水配制。
8.用大口滴管或吸头操作,以尽量减少打断DNA的可能性。
9.要用新鲜样品或液氮冷冻-70度保存的样品。这样通过降低内切酶的活性DNA的降解。
10.避免剧烈吸打DNA,不能搅动基因组DNA。
11.吸取基因组DNA时,要用专用的粗口吸头,普通吸头可能会切断DNA或造成DNA缺口。
12.在准备实验的过程中,应将DNA样品放在碎冰上。
13.加缓冲液后,为了加速DNA溶解,可以轻轻晃动或轻弹试管。
14.加入缓冲液后,置于4度过夜,也可以溶解DNA。
15.将DNA溶液65度温育10分钟,可以灭活DNase。
16.在抽提过程中如果水相和有机层的界面不太清楚,说明其中蛋白质含量较高,可增加酚/氯仿抽提的次数或适当延长离心的时间。
17.酚抽提时如果上清液太粘稠,无法进行水相转移时,可加入适量TES稀释后再抽提。
以上即是DNA的提取与浓度&纯度的检测及纯度比值相关的基础知识。
关于我们
杭州优米仪器有限公司(UMI)是一家专注实验室仪器及生命科学仪器研发、生产、销售及服务于一体的公司。公司位于杭州西湖科技园内,毗连浙江大学紫金港校区。
我们专注于光学,生物发光领域的研发。拥有17年的光学研发经验,如:近红外,紫外,荧光。目前公司构架,以研发为主,占全公司比例的70%。专业的研发团队,可根据客户的具体需求定制不同仪器的规格及参数,并为客户提供全面的、符合客户使用要求的定制仪器。公司始终坚持以科技创新为宗旨,以差异化的设计理念,持续不断的研发和生产具有创新、较好技术的实验室及生命科学专用仪器设备。
—END—